स्तंभ कोशिकाएँ, जिन्हें स्टेम सेल भी कहा जाता है, ऐसी विशिष्ट कोशिकाएँ हैं जिनमें शरीर के किसी भी अंग की कोशिका के रूप में विकसित होने की अद्वितीय क्षमता होती है. इन कोशिकाओं में दो प्रमुख लक्षण पाए जाते हैं. पहला, ये विभाजन द्वारा अपनी संख्या को दीर्घकाल तक बढ़ाती रहती हैं. दूसरा, ये कुछ निश्चित रासायनिक संकेतों को ग्रहण करने के बाद विशेषीकृत (differentiated) कोशिकाओं में रूपांतरित हो सकती हैं. ये कोशिकाएँ बहुकोशिकीय जीवों में पाई जाती हैं और शरीर के क्षतिग्रस्त भागों को ठीक करने तथा प्राकृतिक मरम्मत प्रक्रिया को संचालित करने में महत्वपूर्ण भूमिका निभाती हैं.
ये कोशिकाएँ केवल क्षतिपूर्ति तक ही सीमित नहीं हैं. बल्कि ये मानव विकास, रोग मॉडलिंग और नए उपचारों के परीक्षण के लिए एक मौलिक उपकरण हैं. इनका अध्ययन वैज्ञानिकों को यह समझने में मदद करता है कि कोशिका स्तर पर रोग कैसे विकसित होते हैं. ये भविष्य में अंग प्रत्यारोपण के लिए विकल्प प्रदान करते हैं. स्तंभ कोशिका शरीर के क्षतिग्रस्त भागों को ठीक करने में भी उपयोगी होती है.
स्तंभ कोशिका में अनुसंधान का ऐतिहासिक विकास
स्तंभ कोशिका अनुसंधान की वैचारिक नींव एक शताब्दी से भी अधिक पुरानी है. रूसी वैज्ञानिक अलेक्जेंडर मॉक्सिमोर ने वर्ष 1909 में पहली बार “स्टेम सेल” शब्द का वैज्ञानिक प्रयोग प्रस्तावित किया था. 1960 के दशक से कनाडा के वैज्ञानिकों ने इस क्षेत्र में लगातार अनुसंधान किया. यह अनुसंधान ही इस क्षेत्र के लिए एक ठोस वैज्ञानिक आधार बना.
वर्ष 1998 इस क्षेत्र में मील का पत्थर तब स्थापित हुआ. इस साल पहली बार मानव भ्रूणीय स्तंभ कोशिकाओं को प्रयोगशाला में उत्पन्न किया गया. यह उपलब्धि अमेरिका के विस्कॉन्सिन-मैडिसन विश्वविद्यालय के वैज्ञानिकों ने हासिल की थी.
यह शोध चिकित्सा जगत में एक बहुत बड़ी क्रांति लेकर आया. इन कोशिकाओं में शरीर के किसी भी अंग की कोशिका में बदलने की क्षमता थी. इस खोज ने ऊतक पुनर्जनन (tissue regeneration), बीमारियों के अध्ययन और नई दवाओं के विकास जैसे क्षेत्रों में नई संभावनाओं के द्वार खोल दिए.
लेकिन इसके साथ ही एक गहरा नैतिक विवाद भी उत्पन्न किया. चूँकि इन कोशिकाओं को प्राप्त करने के लिए भ्रूण का विनाश करना पड़ता था. इसलिए यह प्रक्रिया “प्रो-लाइफ” कार्यकर्ताओं और वैज्ञानिकों के बीच एक प्रमुख बहस का कारण बन गई.
इस नैतिक और कानूनी चुनौती ने वैज्ञानिकों को नवाचार के लिए उत्प्रेरित किया. भ्रूणीय अनुसंधान पर लगी पाबंदियों ने वैज्ञानिकों को एक वैकल्पिक और नैतिक रूप से स्वीकार्य मार्ग खोजने के लिए प्रेरित किया. इसी आवश्यकता के फलस्वरूप, वर्ष 2012 में शिन्या यामानाका और जॉन बी. गर्डन ने एक क्रांतिकारी विधि का आविष्कार किया. इसके लिए उन्हें संयुक्त रूप से चिकित्सा का नोबेल पुरस्कार भी प्रदान किया गया.
उन्होंने वयस्क कोशिकाओं को वापस प्लूरीपोटेंट अवस्था में “री-प्रोग्राम” करने का तरीका खोजा, जिससे इंड्यूज़्ड प्लूरीपोटेंट स्टेम सेल्स (iPSCs) का निर्माण हुआ. इस खोज ने भ्रूण अनुसंधान के नैतिक मुद्दों को दरकिनार करते हुए आगे बढ़ने की अनुमति दी.
भ्रूणीय स्तंभ कोशिकाओं का वर्गीकरण
इन कोशिकाओं को दो प्रकार में वर्गीकृत किया जा सकता है-
1. भ्रूणीय स्तंभ कोशिकाएँ (Embryonic Stem Cells)
2. वयस्क स्तंभ कोशिकाएँ (Adult Stem Cells)
भ्रूणीय स्तंभ कोशिकाएँ (Embryonic Stem Cells):
भ्रूण की शुरुआती अवस्था से प्राप्त की गई कोशिकाएँ ‘भ्रूणीय स्तंभ कोशिकाएँ’ कहलाती हैं. इस प्रकार की स्तंभ कोशिकाओं से शरीर के लगभग प्रत्येक भाग का निर्माण किया जा सकता है. विभाजित होने की क्षमता के आधार पर इन्हें दो भागों में बाँटा जा सकता है-
(a) टोटीपोटेंट स्तंभ कोशिकाएँ (Totipotent Stem Cells):
अंडाणु (Ovum) तथा शुक्राणु (Sperm) के मिलने से इस प्रकार की स्तंभ कोशिकाओं का निर्माण होता है. इसके शुरुआती कुछ विभाजनों से भी Totipotent Stem Cells की प्राप्ति होती है. इस प्रकार की स्तंभ कोशिकाओं से पूरे जीव का निर्माण किया जा सकता है.
चूँकि इस प्रकार की स्तंभ कोशिकाओं को प्राप्त करने के क्रम में भ्रूण की मृत्यु हो जाती है तथा इनका उपयोग क्लोनिंग हेतु भी किया जा सकता है, इसी कारण चिकित्सीय अनुप्रयोगों की दृष्टि से इस प्रकार की स्तंभ कोशिकाओं की प्राप्ति पर प्रत्येक देश में प्रतिबंध है. परंतु चिकित्सा के क्षेत्र में शोध की दृष्टि से यू.एस.ए. (U.S.A.), चीन, जापान जैसे देशों ने इनकी प्राप्ति की अनुमति दे रखी है. एम्स (AIIMS) में भी भ्रूणीय स्तंभ कोशिका बैंक (Embryonic Stem Cell Bank) की स्थापना की गई है, जहाँ स्टेम सेल (stem cell) चिकित्सा संबंधी रिसर्च किया जा रहा है.
(b) प्लूरीपोटेंट स्तंभ कोशिकाएँ (Pluripotent Stem Cells):
Totipotent Stem Cells के विभाजन से Pluripotent Stem Cells का निर्माण होता है. इन्हें पश्च भ्रूणीय अवस्था (Later Embryonic Stage), गर्भनाल के रक्त से तथा गर्भपात के बाद प्राप्त हुए भ्रूण (12 सप्ताह के अंदर हुए गर्भपात) से प्राप्त किया जा सकता है. इन्हें प्राप्त करना अपेक्षाकृत आसान है. अतः गर्भनाल के रक्त से प्राप्त स्तंभ कोशिकाओं को स्टेम सेल बैंक में सुरक्षित रखवाया जा सकता है, ताकि आने वाले समय में चिकित्सकीय उपयोग की दृष्टि से उनका उपयोग किया जा सके. ये स्तंभ कोशिकाएँ भी लगभग प्रत्येक प्रकार की कोशिका में बदल सकती हैं.
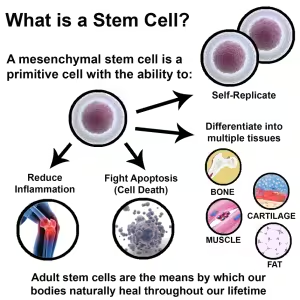
वयस्क स्तंभ कोशिकाएँ (Adult Stem Cells)
ये स्तंभ कोशिकाएँ संपूर्ण शरीर में पाई जाती हैं. ये बच्चों में वृद्धों की अपेक्षा अधिक संख्या में उपस्थित होती हैं. शरीर की टूट-फूट होने पर ये क्षतिपूर्ति के लिये आवश्यक होती हैं. विभाजित होने की क्षमता के आधार पर इन्हें निम्नलिखित भागों में बाँटा जा सकता है-
- मल्टीपोटेंट स्तंभ कोशिकाएँ (Multipotent Stem Cells): ये कुछ निश्चित प्रकार की कोशिकाओं में ही विभाजित हो सकती हैं. इस प्रकार की स्तंभ कोशिकाएँ अस्थि-मज्जा (Bone-Marrow), वसीय ऊतकों (Adipose Tissues), अक्ल दाँत (Wisdom Tooth) एवं हृदय में पाई जाती हैं. अस्थि मज्जा की स्तंभ कोशिकाएँ ही विभाजित होकर RBCs, WBCs और Platelets बनाती हैं.
- ओलिगोपोटेंट स्तंभ कोशिकाएँ (Oligopotent Stem Cells): ये दो या तीन प्रकार की कोशिकाओं में ही विभाजित हो सकती हैं, जैसे- Lymphoid कोशिकाएँ ही B तथा T कोशिकाएँ (WBCs के कुछ प्रकार) बनाती हैं.
- यूनिपोटेंट स्तंभ कोशिकाएँ (Unipotent Stem Cells): इस प्रकार की स्तंभ कोशिकाएँ एक ही प्रकार की कोशिकाओं में बदल सकती हैं.
- इंड्यूज़्ड प्लूरीपोटेंट स्तंभ कोशिकाएँ (Induced Pluripotent Stem Cells-iPSCs): Pluripotent Stem Cells चिकित्सीय दृष्टि से अत्यंत उपयोगी हैं. प्लूरीपोटेंट स्तंभ कोशिकाएँ, भ्रूणीय स्तंभ कोशिकाओं के ही प्रकार हैं. ध्यातव्य है कि भ्रूणीय स्तंभ कोशिकाएँ भ्रूण की आरंभिक अवस्था से प्राप्त की जाती हैं. चूँकि यह प्रक्रिया अनैतिक तथा विवादित है, अतः विश्व के अधिकांश देशों में यह प्रतिबंधित है. इस कारण शिन्या यामानाका (Shinya Yamanaka) तथा जॉन बी. गर्डन (John B. Gurdon) ने वयस्क कोशिकाओं (Adult Cells) को Pluripotent Stem Cells में बदलने की विधि का आविष्कार किया, जिन्हें Induced Pluripotent Stem Cells (iPSCs) कहा जाता है. इस कार्य के लिये दोनों वैज्ञानिकों को संयुक्त रूप से 2012 का चिकित्सा का नोबेल पुरस्कार प्रदान किया गया था.
iPSC टेक्नोलॉजी की मदद से अनेक रोगों, जैसे- पार्किसन, पेशीय दुर्विकास (Muscular Dystrophy) तथा विकलांगता को दूर किया जा सकता है.
स्तंभ कोशिकाओं की उपयोगिता (Utility of Stem Cells)
- इसके द्वारा अल्ज़ाइमर, पार्किसन व मधुमेह जैसी बीमारियों का इलाज अत्यंत सरल हो जाएगा.
- इन कोशिकाओं के द्वारा मानव विकास की प्रक्रिया के उस प्रत्येक चरण को समझा जा सकेगा जिसे गर्भाशय में विकसित हो रहे भ्रूण से समझना कठिन है.
- इन कोशिकाओं में विकसित ऊतक के माध्यम से कॉर्निया का प्रत्यारोपण सुगमतापूर्वक किया जा सकेगा.
- इसके द्वारा नई अस्थियों का विकास कर अस्थि संबंधी व्याधियों के उपचार को सरल बनाया जा सकेगा.
- भविष्य में दवाओं का परीक्षण स्तंभ कोशिकाओं से बने भ्रूण पर किया जाना संभव हो सकेगा, जिससे बंदरों व चूहों की आवश्यकता नहीं पड़ेगी.
- अस्थि-मज्जा की स्तंभ कोशिकाओं से रक्त कोशिकाएँ (Blood Cells) बनाई जा सकती हैं, जिससे रक्त संचार प्रणाली से संबंधित बीमारियों पर नियंत्रण स्थापित किया जा सकेगा.
- एच.आई.वी. संक्रमण से नष्ट हुई कोशिकाओं को फिर से बनाया जा सकेगा.
जोखिम और चुनौतियाँ
अत्यधिक संभावनाओं के बावजूद, स्तंभ कोशिका चिकित्सा को कई महत्वपूर्ण चुनौतियों का सामना करना पड़ता है:
ट्यूमर (टेराटोमा) का खतरा
यह स्तंभ कोशिका चिकित्सा के लिए सबसे बड़ी चुनौतियों में से एक है. प्लूरीपोटेंट स्तंभ कोशिकाओं की एक अनूठी विशेषता यह है कि वे तीनों प्राथमिक जर्म परतों (एक्टोडर्म, मेसोडर्म, और एंडोडर्म) से कोशिकाओं में अंतर कर सकती हैं. यदि कुछ अविभेदित प्लूरीपोटेंट कोशिकाएँ प्रत्यारोपण के बाद बच जाती हैं, तो वे एक ट्यूमर का निर्माण कर सकती हैं. इसे टेराटोमा कहा जाता है. अध्ययन से पता चला है कि iPSCs में टेराटोमा बनाने की क्षमता भ्रूणीय स्तंभ कोशिकाओं की तुलना में अधिक होती है.
वैज्ञानिक इस जोखिम को कम करने के लिए कई रणनीतियों पर काम कर रहे हैं. इसके लिए पुनः प्रोग्रामिंग विधियों में सुधार, शुद्ध, विभेदित कोशिकाओं का चयन और “आत्मघाती जीन” (suicide genes) या “सर्वाइविन इनहिबिटर” (survivin inhibitors) जैसी तकनीकों का उपयोग करके टेराटोमाजनक कोशिकाओं को समाप्त करने पर काम किया जा रहा है.
प्रतिरक्षा अस्वीकृति (Immune Rejection)
प्रत्यारोपण के बाद प्रतिरक्षा अस्वीकृति एक और प्रमुख जोखिम है. जब रोगी की अपनी कोशिकाओं (ऑटोलॉगस) का उपयोग किया जाता है, तो अस्वीकृति का जोखिम कम होता है. हालांकि, जब एक दाता की कोशिकाओं (एलोजेनिक) का उपयोग किया जाता है, तो “ग्राफ्ट-बनाम-होस्ट रोग” (GVHD) नामक एक जोखिम उत्पन्न हो सकता है. इस स्थिति में, दाता की प्रतिरक्षा कोशिकाएँ प्राप्तकर्ता के शरीर को विदेशी मानकर हमला करती हैं.
अन्य जटिलताएँ
हेमेटोपोएटिक स्टेम सेल ट्रांसप्लांटेशन जैसी प्रक्रियाओं से संक्रमण, कीमोथेरेपी से जुड़ी जटिलताएँ, और अस्थायी दुष्प्रभाव जैसे सिरदर्द, जी मिचलाना और बुखार का जोखिम होता है. कुछ मामलों में, उपचार के कई वर्षों बाद कैंसर के दोबारा होने या नई कैंसर कोशिकाओं के विकसित होने की संभावना भी हो सकती है.
भारत में स्तंभ कोशिका अनुसंधान
स्तंभ कोशिका अनुसंधान में प्राथमिक नैतिक बहस मानव भ्रूण को अनुसंधान उद्देश्यों के लिए उपयोग करने और नष्ट करने के इर्द-गिर्द घूमती है. जो लोग मानते हैं कि निषेचित भ्रूण एक जीवन है, वे भ्रूण के विनाश को नैतिक रूप से गलत मानते हैं. इस कारण इस क्षेत्र में अनुसंधान और फंडिंग पर कई प्रतिबंध लगे हैं. रोगी के शरीर से प्राप्त होने वाले वयस्क स्तंभ कोशिकाएँ इस नैतिक मुद्दे को दरकिनार करती हैं. इंड्यूज़्ड प्लूरीपोटेंट स्टेम सेल्स (iPSCs) के आविष्कार ने इस समस्या का एक और समाधान प्रदान किया है. इस कारण भ्रूण को नष्ट किए बिना ही प्लूरीपोटेंट कोशिकाओं पर अनुसंधान संभव हो पाया है.
भारत में स्तंभ कोशिका अनुसंधान के लिए सरकारी दिशानिर्देश
भारतीय चिकित्सा अनुसंधान परिषद (ICMR) और जैव प्रौद्योगिकी विभाग (DBT) ने 2007 में विस्तृत “स्टेम सेल रिसर्च एंड थेरेपी दिशानिर्देश” जारी किए है. इन दिशानिर्देशों का उद्देश्य यह सुनिश्चित करना है कि अनुसंधान एक जिम्मेदार और नैतिक तरीके से आयोजित किया जाए.
प्रमुख प्रावधानों में एक बहुस्तरीय नियामक संरचना शामिल है. राष्ट्रीय स्तर पर राष्ट्रीय एपिक्स समिति (National Apex Committee for Stem Cell Research and Therapy – NAC-SCRT) और संस्थागत स्तर पर संस्थागत समिति (Institutional Committee for Stem Cell Research and Therapy – IC-SCRT) में पंजीकरण अनिवार्य है.
इस क्षेत्र में अनुसंधान के दिशानिर्देशों को तीन श्रेणियों में वर्गीकृत किया जा सकता हैं:
- अनुमेय (Permissible): इसमें स्थापित मानव भ्रूणीय और iPSC लाइनों पर अनुसंधान शामिल है, जिसके लिए आईसीएसआरटी की पूर्व अनुमति आवश्यक है.
- प्रतिबंधात्मक (Restrictive): इसमें आईवीएफ, आईसीएसआई या एससीएनटी जैसी प्रक्रियाओं के माध्यम से मानव पूर्व-प्रत्यारोपण भ्रूण से नई भ्रूणीय स्तंभ कोशिका लाइनें प्राप्त करना शामिल है. ऐसे अनुसंधान के लिए एनएसी-एससीआरटी की मंजूरी की आवश्यकता होती है.
- निषिद्ध (Prohibited): इसमें मानव जर्मलाइन जीन थेरेपी और प्रजनन क्लोनिंग शामिल है, जिस पर पूर्ण प्रतिबंध है.
नैदानिक परीक्षणों के लिए भी सख्त नियम हैं. उन्हें सीडीएससीओ (Central Drugs Standard Control Organisation) से मंजूरी लेनी होती है और सीटीआरआई (Clinical Trials Registry-India) में पंजीकृत होना पड़ता है. इसके अतिरिक्त, न्यूनतम दो साल की अनिवार्य फॉलो-अप अवधि और सभी प्रतिकूल घटनाओं की रिपोर्टिंग आवश्यक है. यह नियामक ढाँचा न केवल सुरक्षित और नैतिक अनुसंधान सुनिश्चित करता है, बल्कि वैज्ञानिक अखंडता को भी बढ़ावा देता है. यह भारत की परिपक्व और जिम्मेदार वैज्ञानिक पारिस्थितिकी तंत्र का प्रमाण है.
भारत में प्रमुख अनुसंधान केंद्र
भारत में कई संस्थान स्तंभ कोशिका अनुसंधान के क्षेत्र में अग्रणी भूमिका निभा रहे हैं. इनमें नेशनल सेंटर फॉर बायोलॉजिकल साइंसेज (NCBS) – बंगलूरू, इंस्टीट्यूट फॉर स्टेम सेल बायोलॉजी एंड रीजेनेरेटिव मेडिसिन (inStem) – बंगलूरू, नेशनल सेंटर फॉर सेल साइंस (NCCS) पुणे, इंटरनेशनल सेंटर फॉर स्टेम सेल्स, कैंसर एंड बायोटेक्नोलॉजी (ICSCCB) – पुणे, सेंटर फॉर स्टेम सेल साइंसेज (CSCS) हैदराबाद, स्कूल ऑफ रीजेनेरेटिव मेडिसिन (SORM) मणिपाल (कर्नाटक), एल.वी. प्रसाइ आई इंस्टीट्यूट (LVPEI) हैदराबाद, पी.जी.आई.एम.ई.आर. चंडीगढ़, एस.जी.पी.जी.आई.एम.एस. लखनऊ और क्रिश्चियन मेडिकल कॉलेज (CMC) वेल्लोर शामिल हैं.
अखिल भारतीय आयुर्विज्ञान संस्थान (AIIMS) नई दिल्ली हृदय और तंत्रिका संबंधी विकारों सहित विभिन्न स्थितियों में उन्नत स्तंभ कोशिका अनुसंधान में संलग्न एक प्रमुख संस्थान है. चंडीगढ़ में पोस्ट ग्रेजुएट इंस्टीट्यूट ऑफ मेडिकल एजुकेशन एंड रिसर्च (PGIMER) के शोधकर्ताओं ने ऑटोलॉगस रक्त से लागत-प्रभावी ‘न्यूरोवास्कुलर ऑर्गेनॉइड/भ्रूण’ विकसित करने का एक प्रोटोटाइप तैयार किया है. यह एक उत्कृष्ट उदाहरण है कि भारत में अभिनव और लागत-प्रभावी अनुसंधान कैसे हो रहा है.
भारत का पशु स्टेम सेल बायोबैंक
जैव प्रौद्योगिकी के क्षेत्र में भारत की रणनीतिक दूरदर्शिता का एक उत्कृष्ट उदाहरण हैदराबाद के राष्ट्रीय पशु जैव प्रौद्योगिकी संस्थान (NIAB) में भारत के पहले अत्याधुनिक पशु स्टेम सेल बायोबैंक है. इस बायोबैंक का उद्देश्य पशु चिकित्सा के क्षेत्र में पुनर्योजी चिकित्सा और सेलुलर थेरेपी में अनुसंधान को बढ़ावा देना है. पशुओं के रोगों के निदान और उपचार में क्रांति लाकर, यह बायोबैंक न केवल पशुधन की उत्पादकता बढ़ाएगा, बल्कि कृषि से जुड़े राष्ट्रीय सकल घरेलू उत्पाद (GDP) में भी योगदान करेगा.
भारत में गर्भनाल रक्त बैंकिंग
गर्भनाल रक्त बैंकिंग को कॉर्ड ब्लड बैंकिंग भी कहते हैं. यह एक ऐसी प्रक्रिया है जिसमें प्रसव के बाद बच्चे की गर्भनाल से स्तंभ कोशिकाओं को एकत्र करके भविष्य में चिकित्सकीय उपयोग के लिए सुरक्षित रूप से संग्रहीत किया जाता है. यह तरीका बच्चों को भविष्य में 80 से अधिक घातक बीमारियों से बचाने की क्षमता रखता है. यह एक प्रकार का जैविक बीमा है जो बच्चे के लिए जीवन रक्षक बन सकता है.
यह सेवा दो प्रकार के बैंकों द्वारा प्रदान की जाती है: सार्वजनिक और निजी.
| विशेषताएँ | सार्वजनिक बैंक | निजी बैंक |
| उद्देश्य | दान पर आधारित; किसी भी जरूरतमंद रोगी के लिए उपलब्ध | व्यक्तिगत उपयोग के लिए; केवल दाता परिवार के लिए आरक्षित |
| लागत | निःशुल्क | संग्रह और वार्षिक भंडारण शुल्क का भुगतान आवश्यक है |
| पहुँच | सार्वजनिक “मैच रजिस्ट्री” के माध्यम से पहुंच योग्य | केवल परिवार के सदस्यों तक सीमित |
| विनियमन | सख्त गुणवत्ता और बाँझपन (sterility) दिशानिर्देशों का पालन करता है | निजी उपयोग के लिए होने के कारण समान कड़े मानकों की आवश्यकता नहीं होती |
| विशेषज्ञों की राय | अमेरिकी एकेडमी ऑफ पीडियाट्रिक्स और अमेरिकन सोसाइटी फॉर ब्लड एंड मैरो ट्रांसप्लांटेशन सार्वजनिक दान की सलाह देते हैं | विशेषज्ञों की सलाह है कि इनका उपयोग केवल तभी करें जब परिवार में कोई ज्ञात आवश्यकता हो |
भविष्य की दिशाएँ
ऑर्गेनॉइड्स
ऑर्गेनॉइड्स स्तंभ कोशिकाओं से विकसित त्रि-आयामी (3D) सूक्ष्म अंग होते हैं जो वास्तविक मानव अंगों की तरह दिखते और कार्य करते हैं. ये वैज्ञानिकों को यह समझने में मदद करते हैं कि किसी अंग का विकास कैसे होता है और रोग कोशिका स्तर पर कैसे उत्पन्न होते हैं, जैसे कि जीका वायरस का भ्रूण के मस्तिष्क पर प्रभाव.
ये पशु मॉडल और पारंपरिक 2D सेल लाइनों की तुलना में दवा परीक्षण के लिए बेहतर मॉडल हैं. ऑर्गेनॉइड्स पर नई दवाओं की सुरक्षा और प्रभावकारिता का सटीक मूल्यांकन किया जा सकता है, जिससे व्यक्तिगत उपचार रणनीतियों को विकसित करने में मदद मिलती है. चंडीगढ़ के पीजीआईएमईआर द्वारा विकसित लागत-प्रभावी ‘न्यूरोवास्कुलर ऑर्गेनॉइड’ भारत में इस क्षेत्र में हो रही प्रगति का एक उत्कृष्ट उदाहरण है.
जीन एडिटिंग
जीन एडिटिंग (जीनोम एडिटिंग) एक क्रांतिकारी तकनीक है जो किसी खास डीएनए या जीन को जीनोम में डालने, मिटाने या बदलने के लिए विशेष रूप से डिज़ाइन किए गए एंजाइमों का उपयोग करती है. वर्ष 2015 में जीन एडिटिंग के क्षेत्र में क्रिस्पर-कैस9 (CRISPR-Cas9) प्रणाली के आगमन से एक बड़ी क्रांति आई, जिससे वंशानुगत रोगों का इलाज संभव हो पाया.
इस तकनीक का उपयोग सिकल सेल एनीमिया और सिस्टिक फाइब्रोसिस जैसे आनुवंशिक दोषों के कारण होने वाली बीमारियों के इलाज में किया जा सकता है. भविष्य में, यह वंशानुगत रोगों के लिए एक स्थायी समाधान प्रदान कर सकता है, जिससे अगली पीढ़ियों को इन बीमारियों से बचाया जा सकता है. हालांकि, इस तकनीक का अनैतिक उपयोग, जैसे कि “डिजाइनर शिशुओं” का निर्माण, एक महत्वपूर्ण नैतिक और सामाजिक चिंता बनी हुई है.



